Qualitätsinitiative Sepsis
Positionspapier zur qualitativen und prozessualen Verbesserung der mikrobiologischen Diagnostik
von Ulf Dennler, Matthias Gründling, Holger Rohde, Evgeny Idelevich und Karsten Becker
Die Diskussion um strukturelle und prozessuale Qualitätsmerkmale bei der Gestaltung von Leistungsgruppen muss Aspekte der Diagnostik pathogener Erreger und der Steuerung der antiinfektiven Therapien berücksichtigen.
- Jährlich werden in den deutschen Krankenhäusern mindestens 180.000 Patienten mit einer Sepsis behandelt. 2 von 5 dieser Patienten sterben. Jeder sechste Todesfall im Krankenhaus steht im kausalen oder zeitlichen Zusammenhang mit einer Sepsis.
- Internationale Vergleiche begründen die Annahme, dass durch eine zeitnahe Behandlung von der Probenentnahme bis zur Einleitung einer zielgerichteten erreger- und resistenzgerechten Therapie zahlreiche Todesfälle vermeidbar wären. Allein eine Reduktion der Krankenhaussterblichkeit von 40 auf 30 Prozent würde etwa 18.000 vermeidbaren Todesfällen entsprechen.
- Die Behandlung von Patienten mit Infektionen gestaltet sich durch die Ausbreitung multiresistenter Erreger, in der Presse oft auch als Killerkeime bezeichnet, zunehmend schwierig.
- Im europäischen Vergleich liegt Deutschland bei relevanten Parametern für eine zeitnahe mikrobiologische Diagnostik und der Einhaltung qualitativer Standards bestenfalls im Mittelfeld.
- Eine schnellere und besser verfügbare mikrobiologische Diagnostik hätte zusätzliche wünschenswerte Nebeneffekte wie die Prävention von im Krankenhaus erworbenen septischen Verläufen oder von langjährigen gesundheitlichen Beeinträchtigungen durch Post-Sepsis-Syndrome.
Bereits im Jahr 2007 haben das Expertengremium Mikrobiologisch-infektiologische Qualitätsstandards (MiQ) und die Qualitätssicherungskommission der Deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM) zusammen mit der Deutschen Gesellschaft für Hämatologie und Onkologie (DGHO), der Deutschen Gesellschaft für Infektiologie (DGI), der Deutschen Gesellschaft für Internistische Intensivmedizin und Notfallmedizin (DGIIN), der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI), der Gesellschaft für Neonatologie und Pädiatrische Intensivmedizin (GNPI) und der Paul-Ehrlich-Gesellschaft für Chemotherapie (PEG) zeitliche Standards für die Präanalytik, die Verarbeitung von Blutproben und die Befundübermittlung gefordert, dass:
- der Transport der beimpften Blutkulturflaschen zum mikrobiologischen Labor schnellstmöglich erfolgen muss, wobei der Zeitraum zwischen Blutkulturabnahme und Eingang der Blutkulturflaschen im mikrobiologischen Labor tagsüber 2–4 Stunden möglichst nicht überschreiten sollte;
- lange Lagerungs- und Transportzeiten unbedingt zu vermeiden sind;
- auch an Wochenenden für einen sofortigen Transport ins Labor zu sorgen ist;
- die Überprüfung und Weiterverarbeitung der Blutkulturen unmittelbar nach Eintreffen der Blutkulturflaschen im Labor zu erfolgen hat und
- u.a. das mikroskopische Ergebnis der Gramfärbung einer positiven Blutkultur, sowie die Ergebnisse der Empfindlichkeitsprüfung und Erregeridentifizierung dem behandelnden Arzt in der Klinik so schnell wie möglich durch den verantwortlichen Arzt im Labor telefonisch mitgeteilt werden müssen. Hierbei ist eine Befundmitteilung durch nichtärztliches Laborpersonal oder an Pflegepersonal bis auf Ausnahmefälle abzulehnen1
Die Autoren des nachfolgenden Vorschlags gehen auf Basis internationaler Studien davon aus, dass durch eine qualitative und prozessuale Verbesserung der mikrobiologischen Diagnostik sowie eine Optimierung der antimikrobiellen medikamentösen Therapie die Sterblichkeit der Sepsis signifikant reduziert werden kann. Eine schnellere Verfügbarkeit der Ergebnisse mikrobiologischer Diagnostik zur Erregeridentifikation und Antiinfektiva-Empfindlichkeitsbestimmung ermöglicht eine frühere gezielte antimikrobielle Behandlung und eine frühere Deeskalation der kalkuliert begonnenen, i.d.R. breiten antiinfektiven Notfallbehandlung.
Eine 24/7-verfügbare mikrobiologische Diagnostik ist als Qualitätsstandard in der Gestaltung der Leistungsgruppen zu berücksichtigen, wenn Patienten mit Sepsis oder komplizierten Infektionen häufig behandelt werden oder die behandelten Patienten durch Alter oder Komorbiditäten besonders vulnerabel sind.
Ziele sind die Reduktion der Krankenhausletalität bei Sepsis und die Reduktion der Inzidenz von nosokomialer Sepsis als Folge einer inadäquaten antiinfektiven Therapie.
Ausgangslage
„Der Transport der beimpften Blutkulturflaschen zum mikrobiologischen Labor muss schnellstmöglich und gegen Abkühlung geschützt (d.h. nicht unter Raumtemperatur) erfolgen. Der Zeitraum zwischen Blutkulturabnahme und Eingang der Blutkulturflaschen im mikrobiologischen Labor sollte tagsüber 2-4 h möglichst nicht überschreiten. Lange Lagerungs- und Transportzeiten sind unbedingt zu vermeiden. Auch an Wochenenden ist für einen sofortigen Transport ins Labor zu sorgen, um ein positives Kulturergebnis möglichst frühzeitig zu erhalten. … Eine länger als 12- bis 16-stündige Zwischenlagerung der beimpften Blutkulturen vor der Weiterverarbeitung ist im Sinne einer optimalen Patientenversorgung nicht akzeptabel. In einer kürzlich veröffentlichten Untersuchung wurde die mittlere Transportzeit für Blutkulturflaschen in das mikrobiologische Labor eines deutschen Universitätsklinikums sowie eines überregional tätigen Anbieters von Laborleistungen mit 21,4 h angegeben, in über 5% der Fälle betrug die Transportzeit sogar über 48 h [Fahr et al. 2005]“15 „Eine Verzögerung der Blutkulturdiagnostik dieser Größenordnung ist mit einer qualitätsorientierten Patientenversorgung kaum vereinbar.“Aus den aktuell vorhandenen Publikationen ist ersichtlich, dass die zu langen Transportzeiten der abgenommenen Blutkulturen ins mikrobiologische Labor ein substanzielles Defizit in der Versorgung der Patienten mit Sepsis darstellen (mittlere bzw. mediane Transportdauer: Deutschland, 2005, 21,4 h; Deutschland, 2015, 13,3 h; Niederlande, 2008, 10,4 h; Schweden, 2013, 9 h)15–18. Die in den mikrobiologischen Qualitätsstandards geforderten Vorgaben können mit den aktuellen Struktur- bzw. Prozessgegebenheiten nicht realisiert werden. Durch limitierte Öffnungszeiten der mikrobiologischen Laboratorien wird die zeitnahe Weiterbearbeitung von außerhalb der Laborarbeitszeiten positiv gewordenen Blutkulturen verhindert19. Mit der Zunahme multiresistenter Erreger und den so zunehmend eingeschränkten Therapiemöglichkeiten wird es immer wichtiger, mikrobiologische Befunde schnellstmöglich für die Therapiesteuerung nutzen zu können. Die steigende Diversifizierung der zugrundeliegenden Resistenzmechanismen einerseits und die spezifischer wirksamen neuen Antiinfektiva andererseits erhöhen die Ansprüche an die Erregerbestimmung und Antiinfektivaempfindlichkeitsbestimmung im mikrobiologischen Labor. Nur mit einer durchgehend (24/7) verfügbaren Erregerdiagnostik und Resistenzbestimmung lässt sich eine optimale Deeskalation der kalkulierten, breiten antibiotischen Initialtherapie hin zu einer gezielten, an den Erreger angepassten Therapie erreichen. Die fortlaufende Verbesserung konventioneller Methoden und insbesondere die Implementierung neuartiger Technologien ermöglichen eine Beschleunigung der Befundung und verbessern gleichzeitig die Sensitivität und Spezifität der Ergebnisse. Zu nennen sind hier insbesondere die „Matrix-assisted-laser-desorption/ionization-time-of-flight“(MALDI-TOF)-Massenspektrometrie und Amplifikations-basierte diagnostische Verfahren20–22. In diesem Kontext erscheint es nicht länger akzeptabel, dass in der S3 Leitlinie „Strategien zur Sicherung rationaler Antibiotika Anwendung im Krankenhaus“ aus dem Jahr 2018, darauf verwiesen wird, dass die initial eingeleiteten antiinfektiven Therapie erst am Tag 3-4 evaluiert werden könne, da in der Regel diagnostische Befunde einschließlich der Mikrobiologie erst zu diesem Zeitpunkt zur Verfügung stünden23. Gleichzeitig enthält die Leitlinie als Strategie für die Therapieoptimierung die Empfehlung, dass relevante mikrobiologische Befunde mit dem behandelnden Arzt umgehend und nachvollziehbar kommuniziert werden sollen. In der Begründung wird die Schlüsselrolle der Mikrobiologie für die Implementierung von ABS-Programmen durch eine zeitnahe Erregerdiagnostik betont. Ergänzend wird auf eine optimierte Präanalytik bezüglich der Probenentnahme, Probenlagerung und Transport in ein geeignetes Labor verwiesen23. Nach der bisherigen Studienlage ist eine frühzeitige Deeskalation der Fortführung der Breitbandantibiose nicht unterlegen. Der sinkende Selektionsdruck beeinflusst die Stabilität des patientenindividuellen Mikrobioms positiv. Mellmann et al. haben gezeigt, dass die frühe Detektion von Erregerübertragungen mittels molekularer Typisierung gezielte Hygienemaßnahmen ermöglichen und Resistenzverbreitung unterbinden24. Die zeitnahe Erregertypisierung ermöglicht so einen zusätzlichen Nutzen für andere Patienten des Krankenhauses und im regionalen Einzugsgebiet, wenn nosokomiale Erregerübertragungen und Infektionen sowie Resistenzentwicklungen verhindert werden können. Positive gesundheitsökonomische Effekte sind dabei sowohl für die Behandlung der einzelnen Patienten als auch für das Gesundheitssystem aus volkswirtschaftlicher Sicht zu erwarten. Generell werden die demographischen und medizinischen Entwicklungen (mehr alte, multimorbide und immunsupprimierte Patienten sowie zunehmende Verwendung von Prothesen und anderen Fremdkörpern), Globalisierung, Migration und Lifestyle-Veränderungen die Ausbreitung von Erregern bzw. Entstehung von Infektionen, insbesondere durch multiresistente Erreger, begünstigen. Nicht zuletzt ist davon auszugehen, dass eine schnelle adäquate Therapie mit weniger Folgeschäden nach überlebter Sepsis (Long-Sepsis) einhergeht. Daten aus Deutschland zeigen, dass aktuell drei Viertel der Überlebenden eine neu aufgetretene Folgeerkrankung hatten und bei einem Drittel eine neu aufgetretene Pflegebedürftigkeit mit den entsprechenden Folgekosten zu verzeichnen war25.
Entwicklung zwischen 2006 und 2021:
Durch die intensive Diskussion um die diagnostischen Kriterien einer Sepsis und die Auswirkungen der korrekten Kodierung auf die Erlössituation im Krankenhaus hat die Zahl der Fälle mit einer Sepsis als kodierter Hauptdiagnose zwischen 2006 und 2019 stetig zugenommen. Im gleichen Zeitraum ist die Zahl der Todesfälle von 15.600 auf 26.600 mit einer Sepsis als Hauptdiagnose gestiegen.
Im Jahr 2020 wurden die diagnostischen Kriterien der Sepsis 3.0 – Definition in der Klassifikation ICD-10 GM und den Deutschen Kodierrichtlinien umgesetzt. Die größte Auswirkung resultierte aus dem Umstand, dass ein Systemisches inflammatorisches Responsesyndrom (SIRS) ohne Organdysfunktion nicht mehr als diagnostisches Kriterium einer Sepsis angesehen wurde.
Infolge dieser Veränderung der Falldefinition und einer Überlagerung der infektiologischen Entwicklung infolge der SARS-CoV-2-Pandemie halbierte sich zwischen 2019 und 2021 die Zahl der Fälle mit einer Sepsis oder einem Septischen Schock als Hauptdiagnose von 150.629 auf 69.2598. Im Gegenzug erhöhte sich die Krankenhaussterblichkeit von 18 auf 33 Prozent.
Inwiefern bei dem Fallzahlanstieg neben Kodiereffekten und demografischem Wandel die Veränderung der Patientenklientel infolge einer Ausweitung immunsuppressiver Behandlungen oder der gestiegenen Versorgung mit Implantaten eine Rolle spielt, kann anhand der zur Verfügung stehenden Informationen nicht geklärt werden. Es ist jedoch ein multifaktorielles Geschehen anzunehmen. Für das Jahr 2021 muss zusätzlich ein Einfluss der Hygienemaßnahmen zur Vermeidung von SARS-CoV-2-Infektionen angenommen werden.
Nachfolgend wird die Entwicklung 2006-2021 sowie der Vergleich mit einer Prognose auf Basis der Fallzahlen des Jahres 2006 beispielhaft für Patienten mit einer Hauptdiagnose aus A40 – Streptokokkensepsis und A41 – Sonstige Sepsis dargestellt.
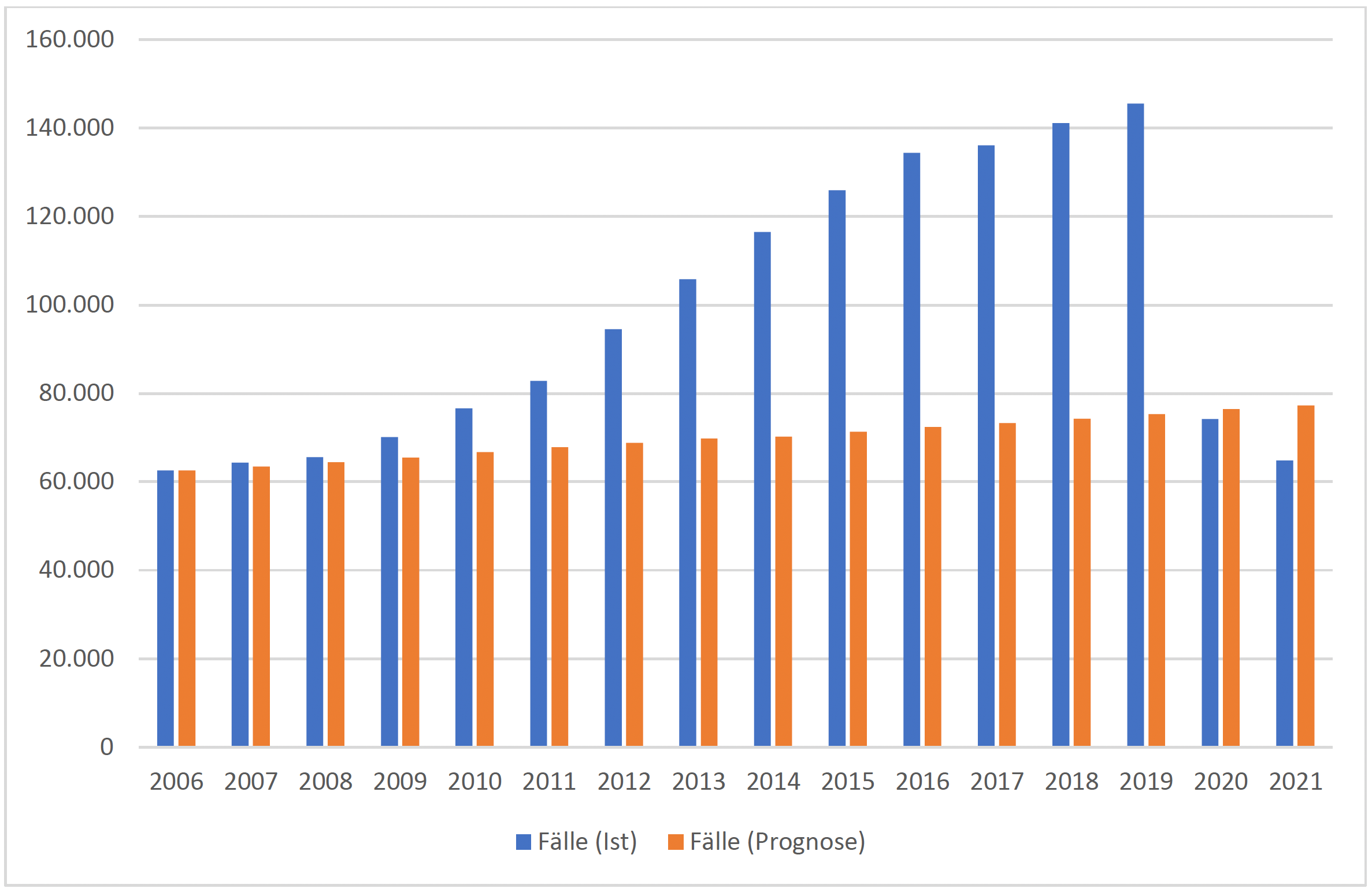
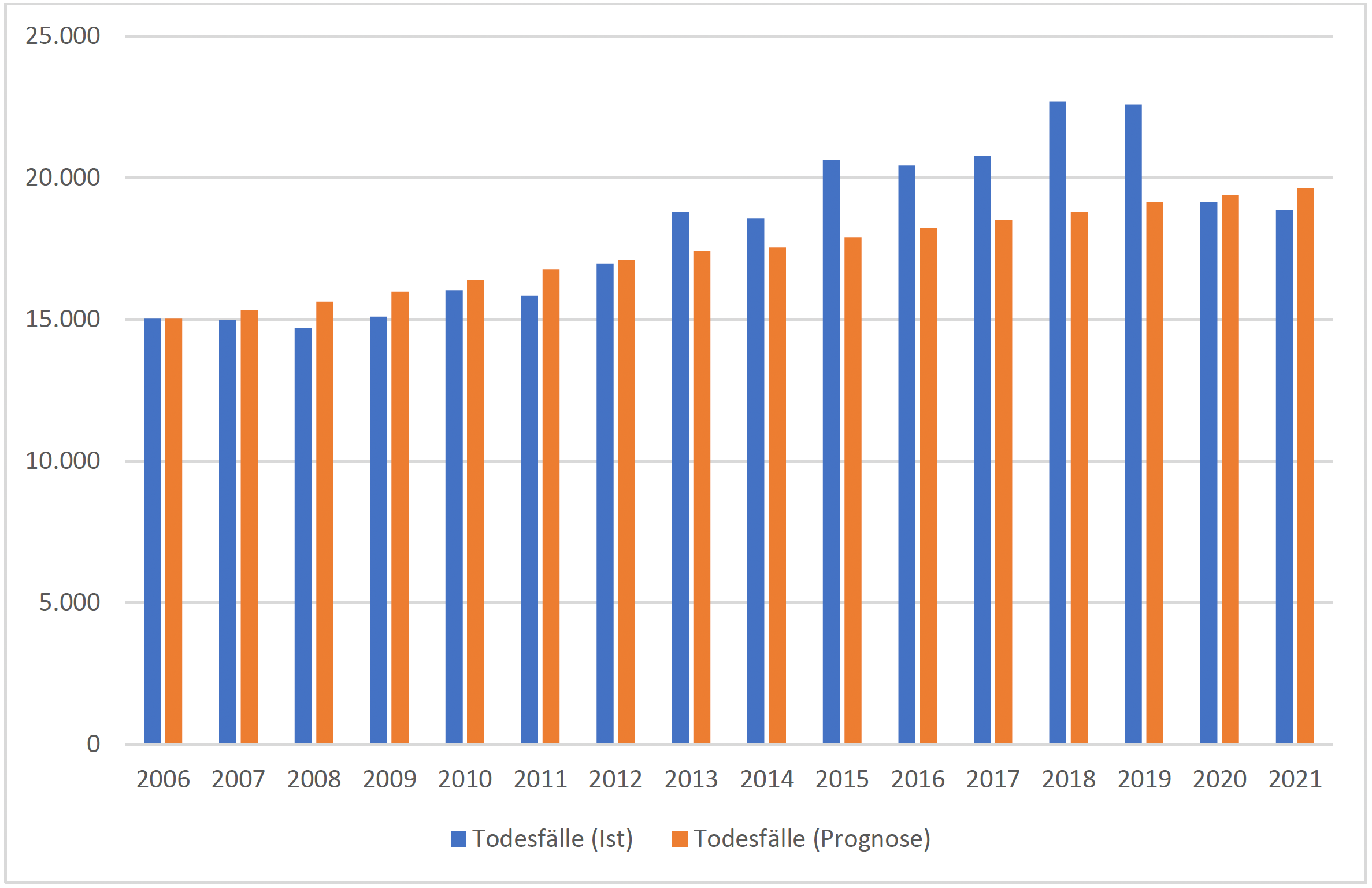
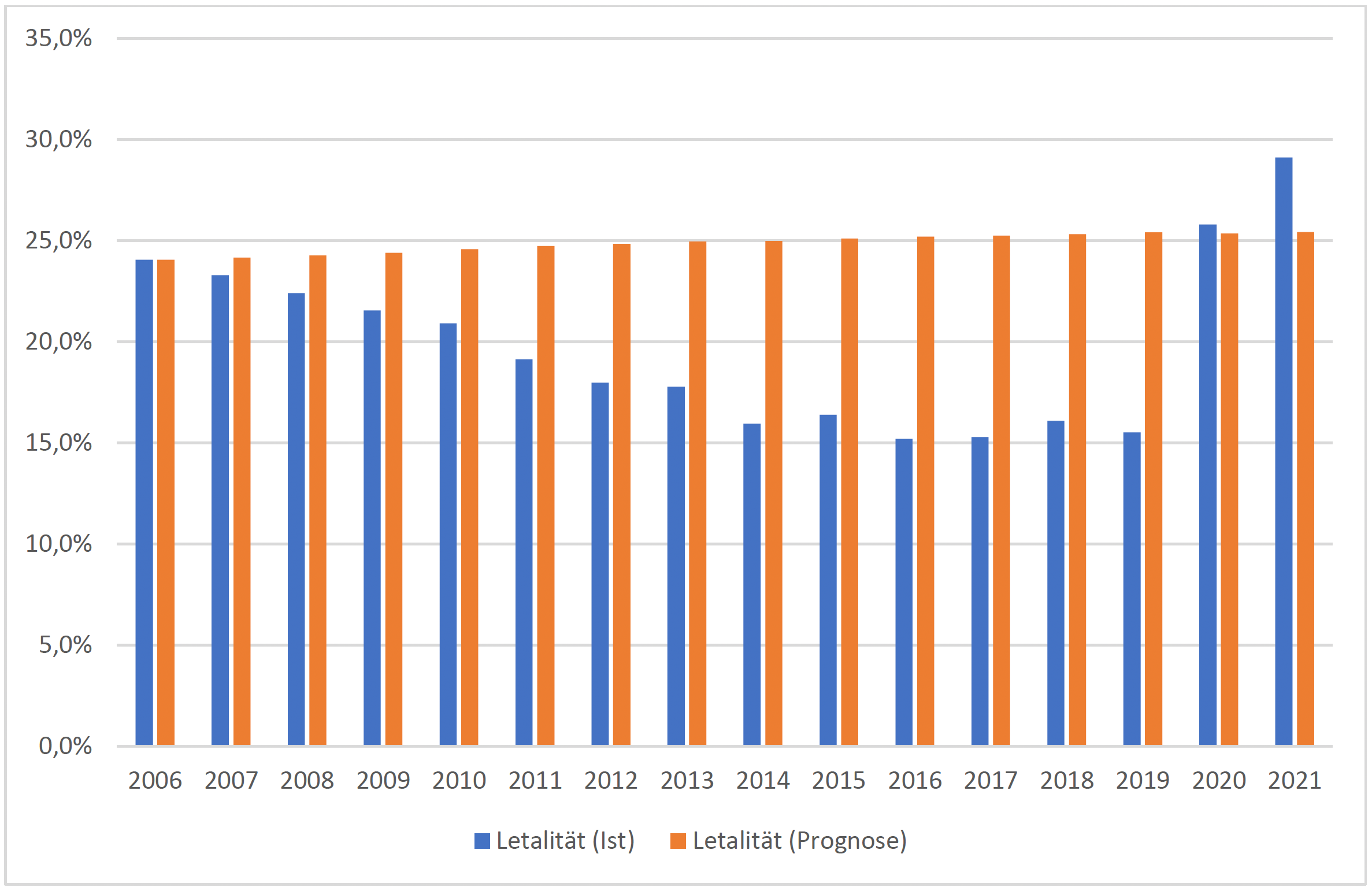
Die Betrachtung ausschließlich der Hauptdiagnosen bildet das Problem der Krankenhaussterblichkeit nur unzureichend ab, da viele Patienten die Sepsis erst im Verlauf einer stationären Behandlung als Nebendiagnose erleiden.
Nachfolgend wurden die Daten der §21-Begleitforschung des Jahres 2022 der im Internet öffentlich zugänglichen Datenbank des Institutes für das Entgeltsystem im Krankenhaus (InEK) in vier Varianten analysiert26:
- Sepsis oder Septischer Schock als Hauptdiagnose
- Sepsis oder Septischer Schock als Hauptdiagnose, Entlassungsgrund Tod
- Sepsis oder Septischer Schock als Nebendiagnose
- Sepsis oder Septischer Schock als Nebendiagnose, Entlassungsgrund Tod
Während Fälle mit einer Sepsis als Hauptdiagnose eineindeutig definiert sind, besteht bei Nebendiagnosen die Gefahr der Überschätzung durch Doppelzählung:
- Angabe einer Sepsis als Haupt- und als Nebendiagnose
- Angabe einer Sepsis und eines Septischen Schocks als Nebendiagnose
- Angabe von zwei oder mehr septischen Schüben durch unterschiedliche Erreger.
Um eine möglichst eindeutige Zählweise bei den Fällen mit einer Nebendiagnose zu erreichen, wurden in diesen Tabellen die Fälle mit einer Hauptdiagnose abgezogen. Eine Mehrfachkodierung von distincten Nebendiagnosen ist bei etwa 10 Prozent aller Sepsisfälle und 20 Prozent aller verstorbenen Sepsisfälle zu finden.
| Hauptdiagnose Sepsis oder Septischer Schock | Nebendiagnose Sepsis oder Septischer Schock | Nebendiagnose bereinigt um Fälle mit Hauptdiagnosen | Gesamtzahl | |
|---|---|---|---|---|
| Fallzahl | 68.709 | 142.542 | 110.951 | 179.660 |
| Todesfälle | 22.522 | 62.033 | 49.320 | 71.842 |
| Sterblichkeit | 33% | 44% | 44% | 40% |
Tabelle 1: Krankenhausfälle mit Sepsis oder Septischem Schock (2022), Quelle InEK, eigene Aufbereitung
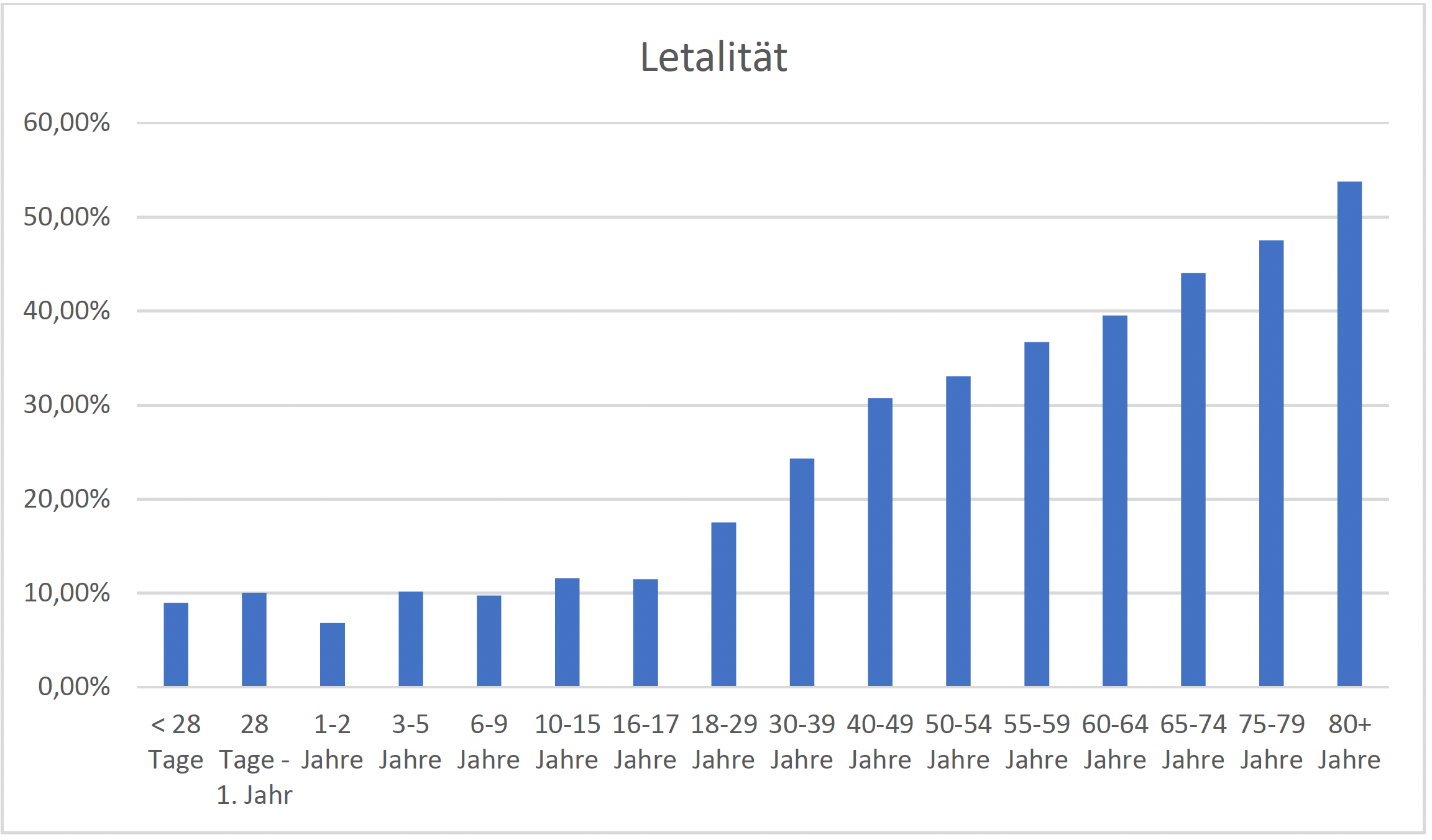
2 von 5 der betroffenen Patienten versterben. Die Sterblichkeit nimmt altersabhängig zu und ist bei einer nosokomialen Sepsis deutlich höher als bei einer ambulant erworbenen.
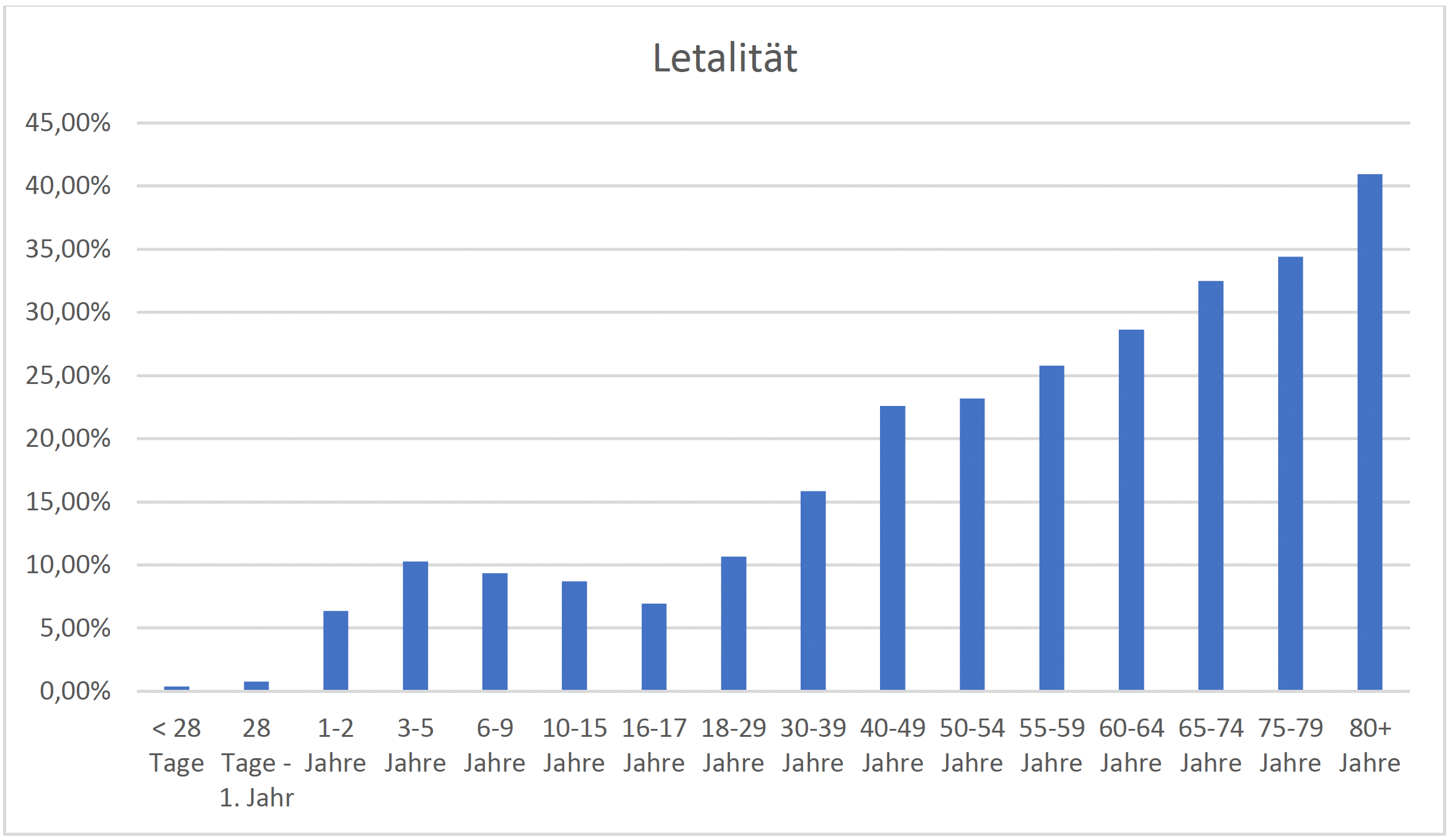
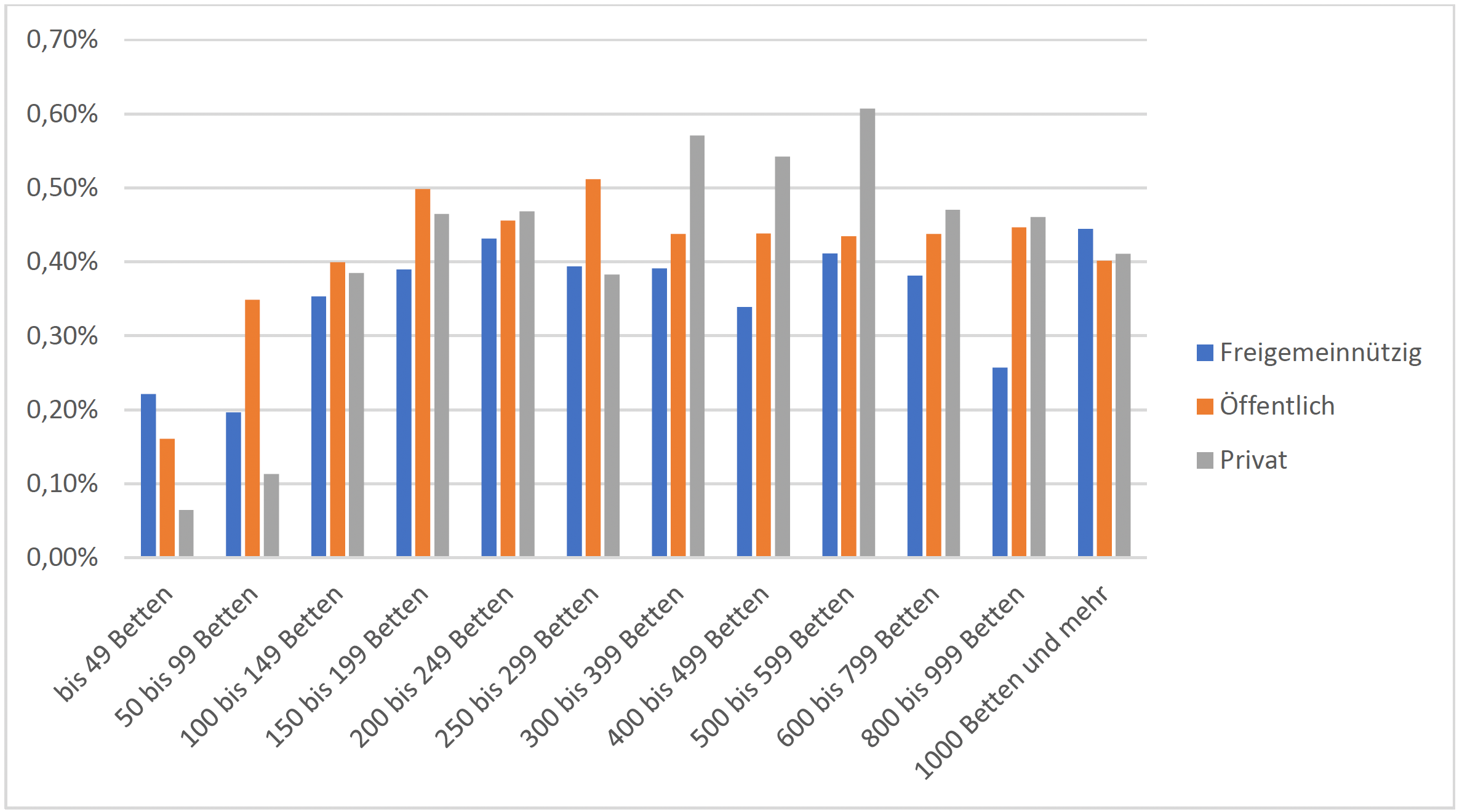
Die Wahrscheinlichkeit, dass ein Patient mit einer ambulant erworbenen Sepsis stationär aufgenommen wird, liegt ab einer Bettenzahl > 150 bei 0,4 bis 0,5 %.
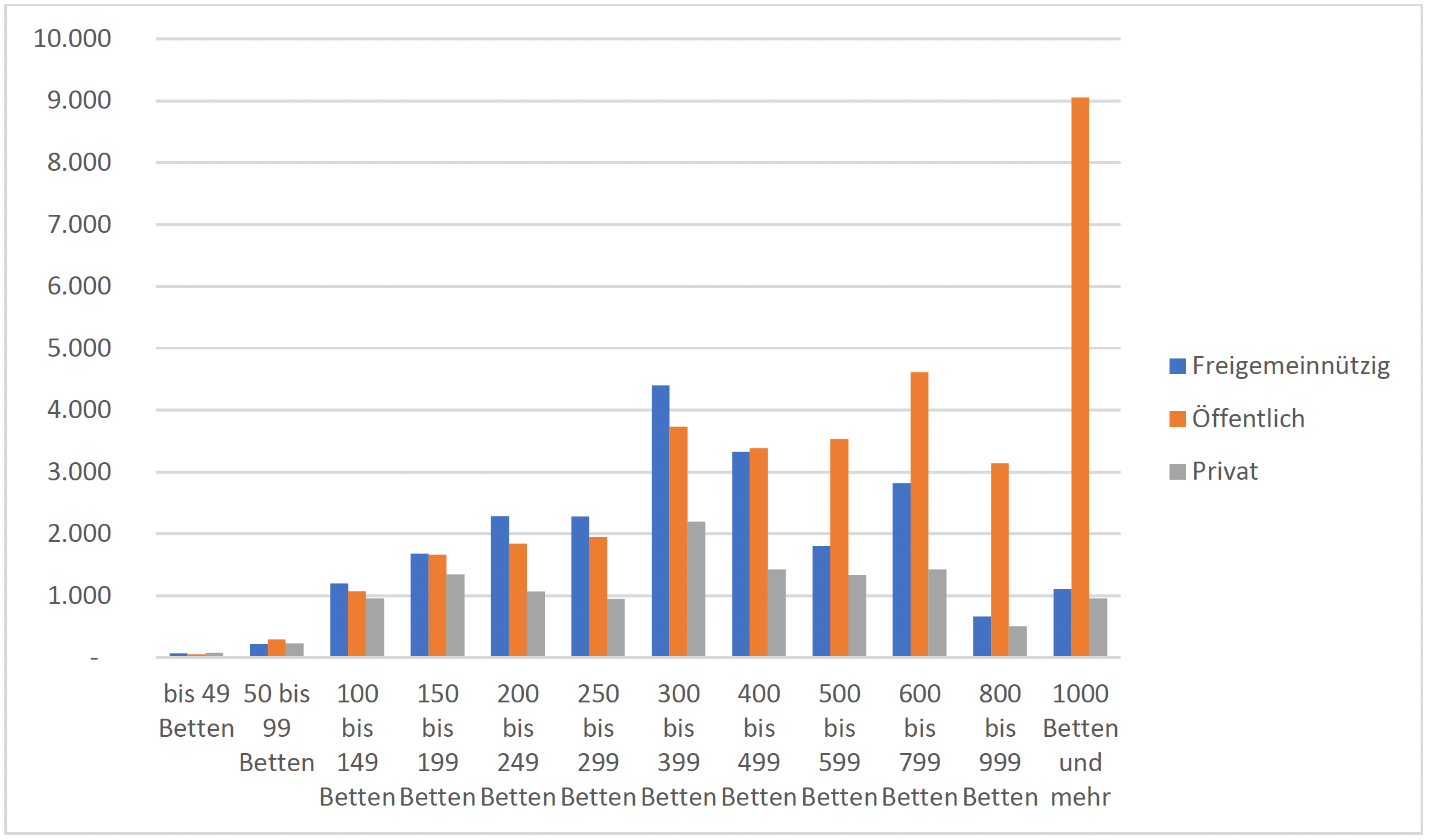
Die Häufigkeit und in geringerem Maße auch die Letalität unterscheiden sich in Abhängigkeit von der Bettenzahl eines Krankenhauses.
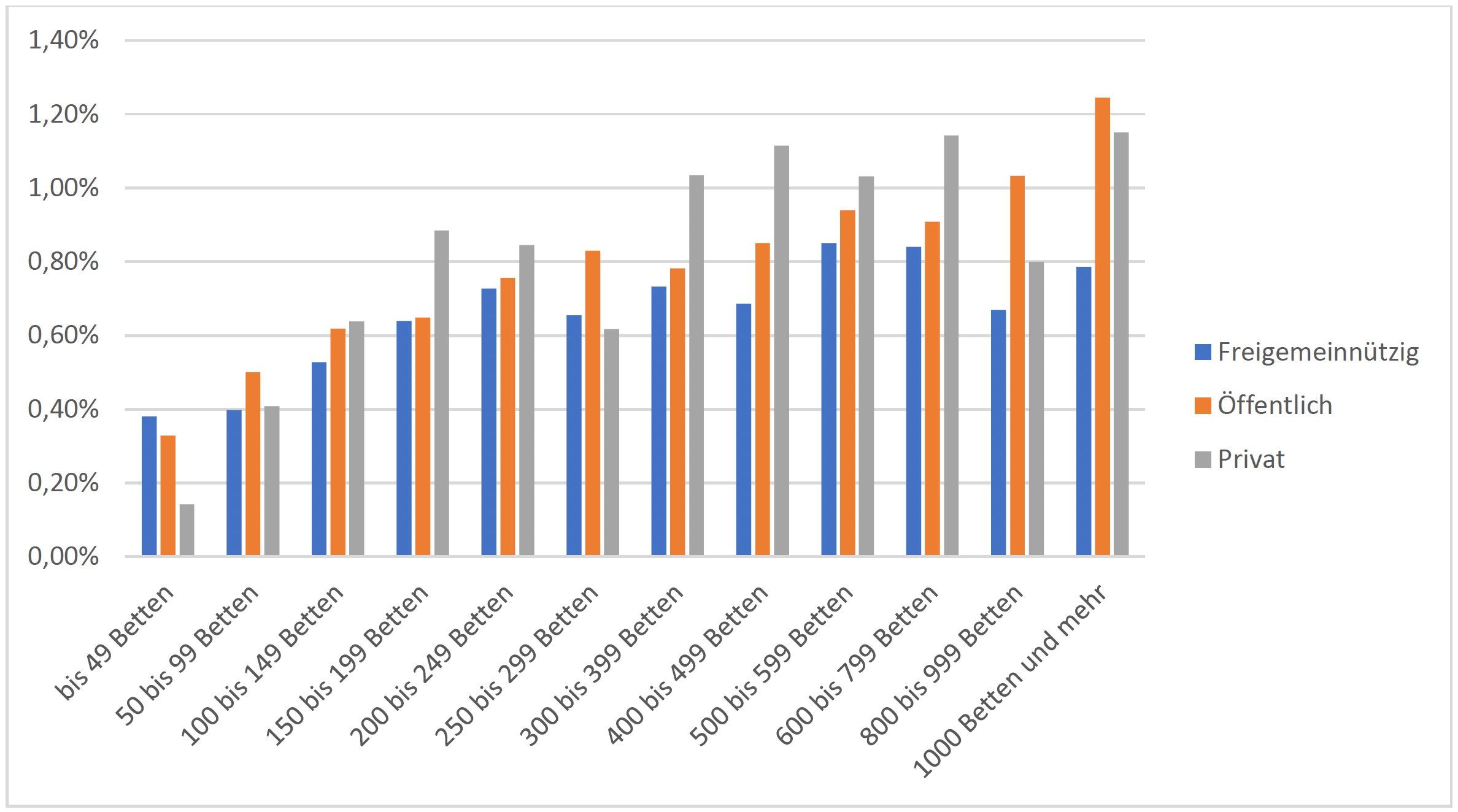
Die Wahrscheinlichkeit, dass ein Patient eine nosokomiale Sepsis entwickelt, steigt mit der Bettenzahl an und liegt bei Maximalversorgern (bei Berücksichtigung von Mehrfachkodierungen) bei 0,8 – 1,2 %.
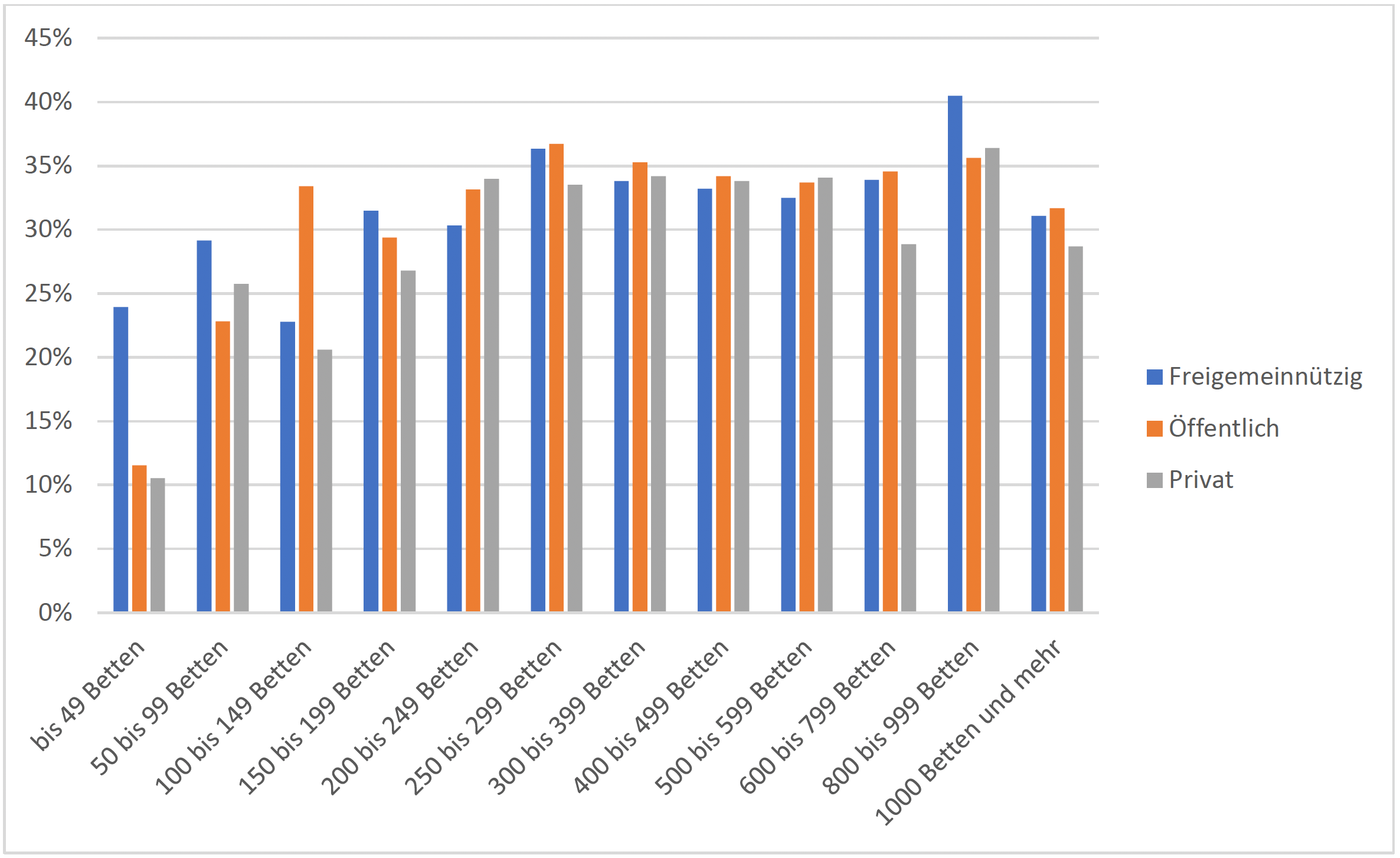
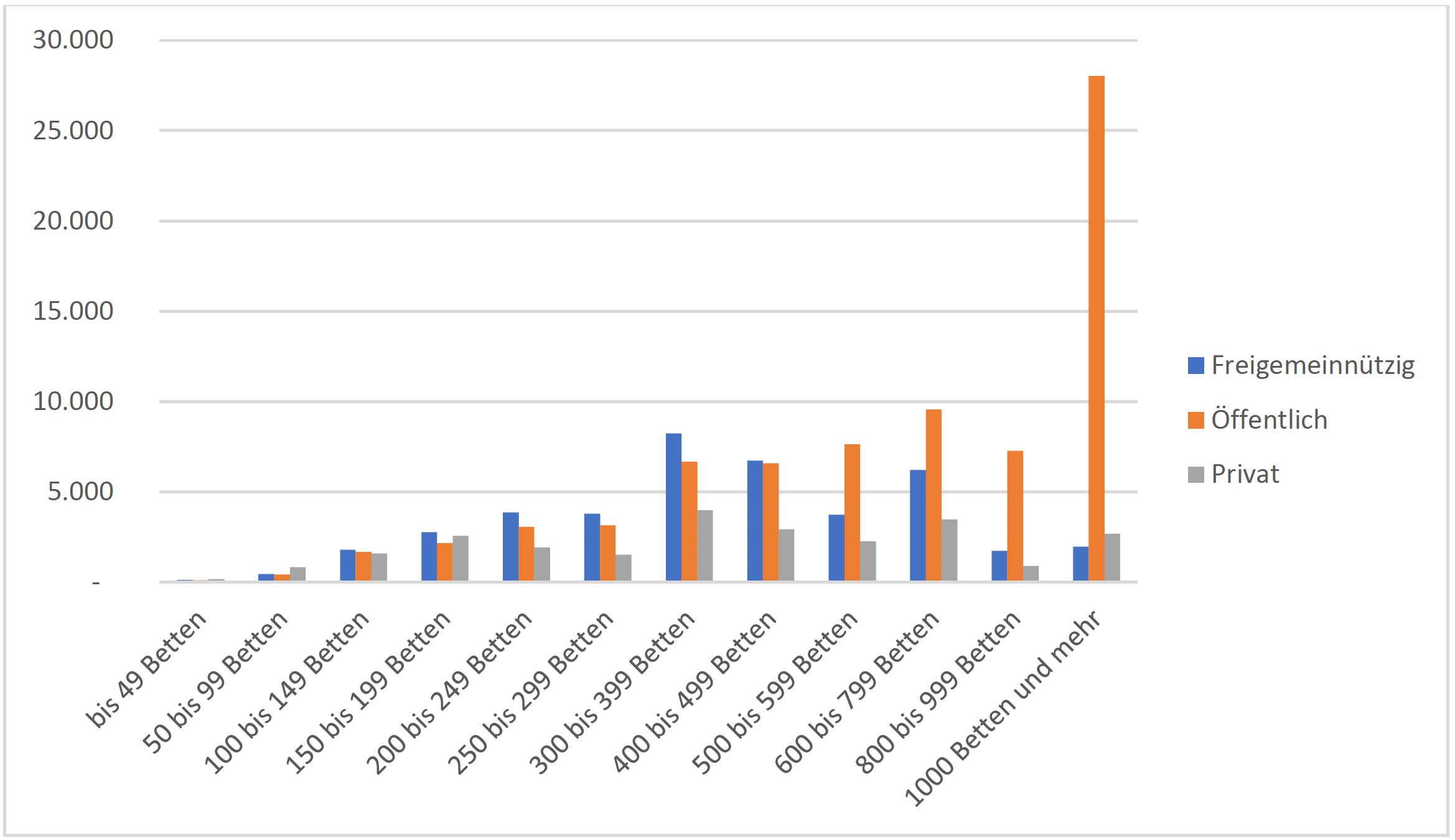
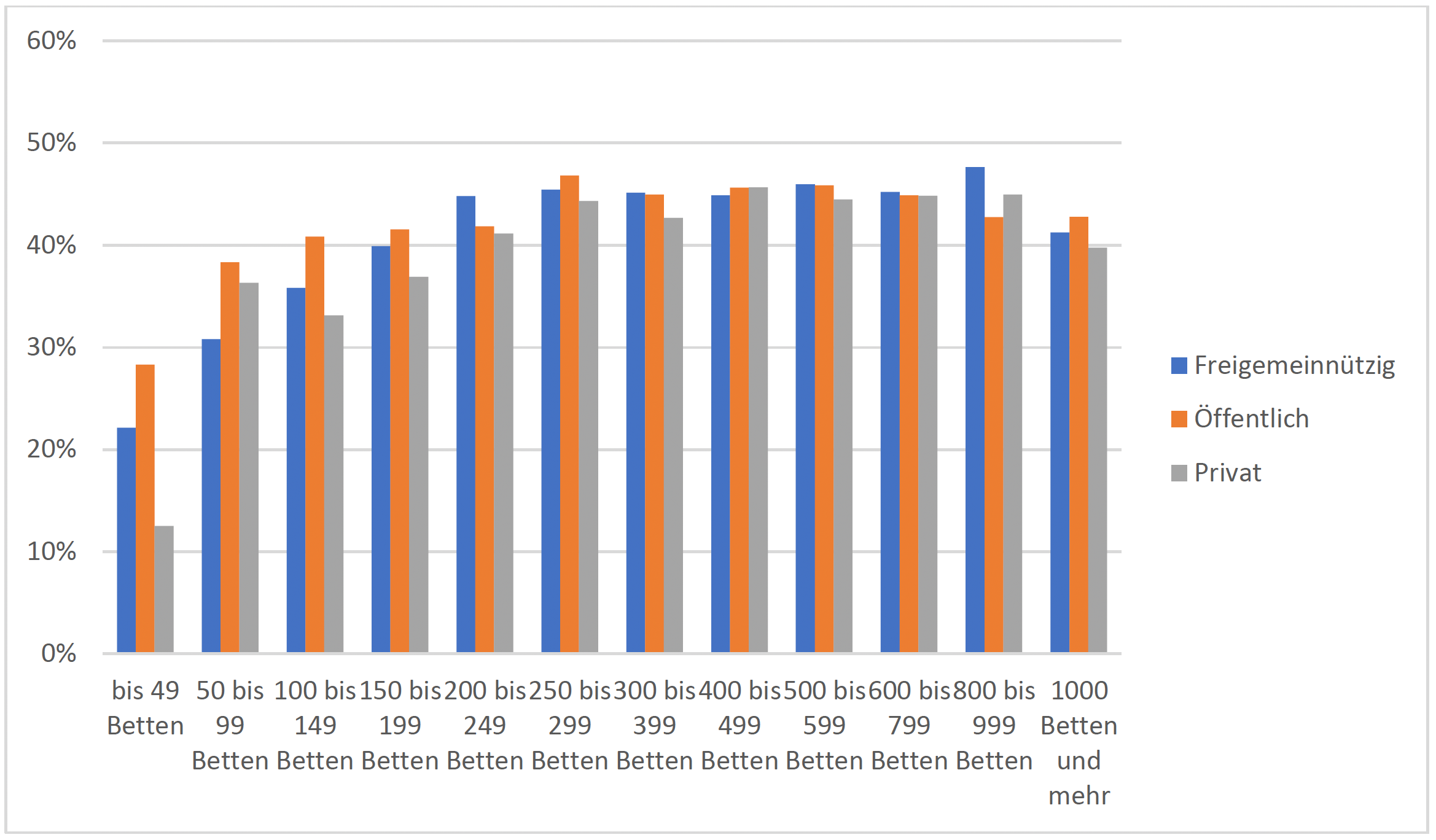
Vorschläge für Prozess- und Strukturmerkmale:
Eine 24/7-verfügbare mikrobiologische Diagnostik ist als Qualitätsstandard in der Gestaltung der Leistungsgruppen zu berücksichtigen, wenn Patienten mit Sepsis oder komplizierten Infektionen häufig behandelt werden oder die behandelten Patienten durch Alter oder Komorbiditäten besonders vulnerabel sind.
- In allen Krankenhäusern mit 300 und mehr Betten soll für die Diagnostik lebensbedrohlicher Infektionen eine mikrobiologische Erregerdiagnostik 24/7 verfügbar sein. Dabei sollen mindestens das Auslesen positiv gemeldeter Proben und die Erstellung eines mikroskopischen Befunds mit Speziesdiagnostik und Schnelltest-Antibiogramms erbracht werden. Die Diagnostik kann in Kooperation erfolgen.
- Im Prozess der Probenentnahme, -verarbeitung und -befundung sollen folgende Mindestmerkmale als qualitativer Standard gesichert werden:
- Probenentnahme innerhalb von einer Stunde nach positivem Screening und vor erster Antiinfektivagabe;
- Beginn der Probenverarbeitung (Start der Inkubation des Untersuchungsmaterials bzw. ggfs. Teststart zusätzlicher molekularer Direktverfahren) möglichst innerhalb von zwei Stunden, spätestens innerhalb von vier Stunden nach der Probenentnahme;
- bei Positivwerden einer Blutkultur verzögerungsfreie Probenverarbeitung zur Erregeridentifizierung und –charakterisierung mittels kultureller und ggfs. nichtkulturbasierter Verfahren einschließlich Resistenztestung;
- Ergebnisinterpretation und –mitteilung unmittelbar nach dem Verfügbarwerden der Ergebnisse (Erregeridentifizierung und Resistenztestung);
- Molekulare Erregertypisierung zur frühzeitigen Unterbrechung von Infektketten (zumindest für multiresistente Erreger).
Zur Realisierung der oben geschilderten Prozessparameter der mikrobiologischen Sepsis-Diagnostik ist die Besetzung des Mikrobiologie-Labors mit MTA in 24/7 Präsenz sowie die durchgehende Gewährleistung des Facharztstandards bei der Ergebnisbefundung und -interpretation (Facharzt oder erfahrene Weiterbildungsassistenten für Mikrobiologie, Virologie und Infektionsepidemiologie) notwendig. Bei Nutzung von Telemedizin und Telemikroskopie ist dies auch in Kooperation zwischen mehreren Laboratorien und Krankenhäusern möglich.
Schnittstellen zur Mikrobiologischen Diagnostik
- In allen Krankenhäusern muss sowohl in den Notaufnahmen, als auch in den stationären Versorgungsbereichen ein kombiniertes Screening auf Sepsis mit NEWS-2 (National Early Warning Score) (Sensitivität) und qSOFA (Spezifität) bei der Aufnahme von Notfallpatienten etabliert sein, um Patienten mit Sepsis/septischem Schock frühzeitig erkennen zu können27–29. Ein alleiniges Screening mittels qSOFA ist aufgrund der unzureichenden Sensitivität als obsolet zu betrachten30.
- Ein im Krankenhaus organisatorisch fest verankertes Antibiotic Stewardship-Konzepts ist als Qualitätsmerkmal für Leistungsgruppen mit Bezug auf die Behandlung von:
- Notfallpatienten
- Intensivpatienten
- Neugeborenen
- Onkologischen Patienten
- Patienten mit Immunsuppression
- Internistische Patienten mit Diabetes mellitus, Chronischer Herzinsuffizienz, Chronisch-obstruktiver Lungenerkrankung, Chronischer Niereninsuffizienz in einem Umfang von mindestens 6 h pro 100 Betten pro Woche sicherzustellen23.
Mit einfachen Screeningverfahren können bedrohte Patienten frühzeitig identifiziert, diagnostiziert und therapiert werden. Das rechtzeitige Erkennen komplizierter Infektionen mit einer drohenden oder einer sich bereits entwickelnden septischen Verlaufsform ist essenziell für die Reduktion der Krankenhausletalität. Die verbindliche Forderung fördert die Awareness, bei unerwarteten Verschlechterungen an eine Sepsis zu denken.
Die Ergebnisse der mikrobiologischen Diagnostik sollen leitlinienkonform als Erreger- und Resistenzstatistiken für die Antibiotic Stewardship-Teams aufbereitet werden.
Literaturverzeichnis
2. Fleischmann, C.; Thomas-Rueddel, D.O.; Hartmann, M.; Hartog, C.S.; Welte, T.; Heublein, S.; Dennler, U.; Reinhart, K. Hospital Incidence and Mortality Rates of Sepsis. Dtsch Arztebl Int 2016, 113, 159-166, doi:10.3238/arztebl.2016.0159. ↑
5. SepNet Critical Care Trials Group. Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study. Intensive Care Med 2016, 42, 1980-1989, doi:10.1007/s00134-016-4504-3. ↑
7. https://sepsis-stiftung.de/mitwirken/ zugegriffen: 4. Juli 2023. ↑
8. IQTIG. Entwicklung eines Qualitätssicherungsverfahrens „Diagnostik, Therapie und Nachsorge der Sepsis“. Abschlussbericht. Erstellt im Auftrag des Gemeinsamen Bundesausschusses. Stand: 31. Mai 2022 IQTIG – Institut für Qualitätssicherung und Transparenz im Gesundheitswesen: Berlin, 2020. ↑
9. Rüddel, H.; Thomas-Rüddel, D.O.; Reinhart, K.; Bach, F.; Gerlach, H.; Lindner, M.; Marshall, J.C.; Simon, P.; Weiss, M.; Bloos, F.; et al. Adverse effects of delayed antimicrobial treatment and surgical source control in adults with sepsis: results of a planned secondary analysis of a cluster-randomized controlled trial. Crit Care 2022, 26, 51, doi:10.1186/s13054-022-03901-9. ↑
10. Seymour, C.W.; Gesten, F.; Prescott, H.C.; Friedrich, M.E.; Iwashyna, T.J.; Phillips, G.S.; Lemeshow, S.; Osborn, T.; Terry, K.M.; Levy, M.M. Time to Treatment and Mortality during Mandated Emergency Care for Sepsis. N Engl J Med 2017, 376, 2235-2244, doi:10.1056/NEJMoa1703058. ↑
11. Liu, V.X.; Fielding-Singh, V.; Greene, J.D.; Baker, J.M.; Iwashyna, T.J.; Bhattacharya, J.; Escobar, G.J. The Timing of Early Antibiotics and Hospital Mortality in Sepsis. Am J Respir Crit Care Med 2017, 196, 856-863, doi:10.1164/rccm.201609-1848OC. ↑
12. Peltan, I.D.; Brown, S.M.; Bledsoe, J.R.; Sorensen, J.; Samore, M.H.; Allen, T.L.; Hough, C.L. ED Door-to-Antibiotic Time and Long-term Mortality in Sepsis. Chest 2019, 155, 938-946, doi:10.1016/j.chest.2019.02.008. ↑
13. Tagashira, Y.; Sakamoto, N.; Isogai, T.; Hikone, M.; Kosaka, A.; Chino, R.; Higuchi, M.; Uehara, Y.; Honda, H. Impact of inadequate initial antimicrobial therapy on mortality in patients with bacteraemic cholangitis: a retrospective cohort study. Clin Microbiol Infect 2017, 23, 740-747, doi:10.1016/j.cmi.2017.02.027. ↑
14. Garnacho-Montero, J.; Gutiérrez-Pizarraya, A.; Escoresca-Ortega, A.; Fernández-Delgado, E.; López-Sanchez, J.M. Adequate antibiotic therapy prior to ICU admission in patients with severe sepsis and septic shock reduces hospital mortality. Crit Care 2015, 19, 302, doi:10.1186/s13054-015-1000-z. ↑
15. Fahr, A.M.; Eigner, U.; Shah, P.M. Einfluss der verzögerten Transportdauer bei Raumtemperatur auf die Rate der falsch negativen Blutkulturen im BACTEC 9000 Gerät. Lab. med. 2005, 29, 130-135. ↑
17. Rönnberg, C.; Mildh, M.; Ullberg, M.; Özenci, V. Transport time for blood culture bottles: underlying factors and its consequences. Diagn Microbiol Infect Dis 2013, 76, 286-290, doi:10.1016/j.diagmicrobio.2013.03.031. ↑
22. Idelevich, E.A.; Becker, K. Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry for Antimicrobial Susceptibility Testing. J Clin Microbiol 2021, 59, e0181419, doi:10.1128/JCM.01814-19. ↑
26. InEK DatenBrowser – Datenlieferung DRG 2022 gruppiert nach 2023; https://datenbrowser.inek.org/DRG2022; zugegriffen: 4. Juli 2023. ↑
27. Sepsis mit effektiven Screeninginstrumenten besser erkennen. https://www.aerzteblatt.de/nachrichten/146129/Sepsis-mit-effektiven-Screeninginstrumenten-besser-erkennen, zugegriffen 16. Oktober 2023. ↑
30. Brunkhorst, F.M.; Weigand, M.; Pletz, M.; Gastmeier, P.; Lemmen, S.W.; Meier-Hellmann, A.; Ragaller, M.; Weyland, A.; Marx, G.; Bucher, M.; et al. S3-Leitlinie Sepsis – Prävention, Diagnose, Therapie und Nachsorge (Langversion 3.1 – 2018, AWMF-Registernummer: 079 – 001); Deutsche Sepsis Gesellschaft e. V. (federführend): 2018. ↑
Die Autoren
Dr. med. Ulf Dennler, MBA
Universitätsklinikum Würzburg
Anstalt des öffentlichen Rechts
Stabsstelle Datengestütztes Krankenhausmanagement
Josef-Schneide-Straße 2
97080 Würzburg
E-Mail: Dennler_U@ukw.de
PD Dr. med. Matthias Gründling
Universitätsmedizin Greifswald
SepsisDialog
Klinik für Anästhesie, Intensiv-, Notfall- und Schmerzmedizin
Ferdinand-Sauerbruch-Straße
17475 Greifswald
E-Mail: matthias.gruendling@med.uni-greifswald.de
Prof. Dr. med. Holger Rohde
Zentrum für Diagnostik
Institut für Medizinische Mikrobiologie, Virologie und Hygiene
Universitätsklinikum Hamburg-Eppendorf (UKE)
Martinistraße 52
20246 Hamburg
E-Mail: rohde@uke.de
Prof. Dr. med. Evgeny A. Idelevich
Universitätsmedizin Greifswald
Friedrich Loeffler-Institut für Medizinische Mikrobiologie
Ferdinand-Sauerbruch-Straße
17475 Greifswald
E-Mail: Evgeny.Idelevich@med.uni-greifswald.de
Prof. Dr. med. Karsten Becker
Universitätsmedizin Greifswald
Friedrich Loeffler-Institut für Medizinische Mikrobiologie
Ferdinand-Sauerbruch-Straße
17475 Greifswald
E-Mail: Karsten.Becker@med.uni-greifswald.de